Технологія штучного насіння та стійкість цукрових буряків до дії гербіцидів
Останнім часом інтенсивно розвиваються технології отримання штучного насіння з розмножуваних у лабораторних умовах (in vitro) рослин. Дана технологія дозволяє отримати велику кількість однорідного рослинного матеріалу, що має здатність до формування цілих рослин. Штучне насіння може служити способом збереження генетичного матеріалу рідкісних видів рослин, тим самим сприяючи збереженню біорізноманіття. Крім того, воно є зручною формою обміну стерильного рослинного матеріалу в дослідницьких цілях.
За матеріалами наукової статті на тему «Синтетичне насіння та стійкі до гербіцидів сорти цукрових буряків (Beta vulgaris L.)» («In vitro synthetic seed and herbicide resistant sugarbeet varieties (Beta vulgaris L.)») журналу «Біонаукові дослідження» («Bioscience Research»), 16(2), 2019 р.
Технологія штучного насіння перспективна для розмноження сільськогосподарських культур. Розмноження деяких видів культур не принесло успіхів внаслідок гетерозиготності насіння, їх дрібного розміру, наявності недорозвиненого ендосперму, вимог насіння в мікоризних грибах для проростання (наприклад, орхідеї), а також в разі деяких безнасінних сортів культур, таких як виноград, кавун та ін. Деякі з цих видів можуть розмножуватися вегетативними способами, однак технологія вегетативного in vivo розмноження є трудомісткою і дорогою. Розробка технології штучного насіння розглядається як ефективний альтернативний метод розмноження деяких важливих сільськогосподарських культур, а також елітних видів рослин із високою комерційною цінністю.
Термін "штучне насіння" часто визначається як аналог ботанічного насіння, що складається з соматичного ембріона, оточеного штучною насіннєвою оболонкою. Це визначення грунтується на схожості соматичного ембріона з зиготним у морфологічному, фізіологічному і біохімічному відношенні. Вчені відзначають, що соматичний ембріон, укладений в штучну насіннєву оболонку, найбільш еквівалентний незрілому зиготному ембріону. У багатьох видів рослин у незрілому ембріоні на цій стадії все ще присутній ендосперм, тканина ендосперму руйнується, коли зиготний ембріон досягає стадії повної зрілості. Отже, соматичний ембріон повинен бути оточений не тільки штучною насіннєвою оболонкою, але також і штучним ендоспермом для того, щоб бути повним аналогом ботанічного насіння, що складається з соматичного ембріона.
Цукровий буряк (Beta vulgaris L.) є одним із важливих ресурсів виробництва цукру серед сільськогосподарських культур і забезпечує близько 40% світового виробництва цукру. Технологія синтетичного (штучного) насіння була розроблена для отримання переваг насіннєвого розмноження шляхом клонального розмноження та зберігання ідіоплазми. Синтетичне насіння можна зберігати при 4°C протягом 12 місяців із використанням кінчиків пагонів, як експланту T. pieninicum без субкультури. Синтетичним насінням можуть бути штучно закапсульовані рослинні паростки, тобто пагони, соматичні ембріони, клітинні з’єднання або будь-яка тканина рослини, які можуть бути посаджені як насіння і мають можливість перетворюватися в цілу рослину в лабораторних умовах або в умовах ex-vitro. Кінчики пагонів і пазушні бруньки також можна використовувати в якості синтетичного насіння. Поєднання хлориду кальцію та альгінату натрію як захисної оболонки рослинних паростків впливає на структуру, форму та прозорість синтетичного насіння. Альгінатна оболонка діє як штучний ендосперм, який забезпечує поглинання поживних речовин експлантатом під час його відростання в оптимальних умовах. Технологія штучного насіння застосовується у комерційних цілях, тому для виробництва синтетичного насіння використовуються різні мікро паростки. Соматичні ембріони також використовуються для виробництва штучного насіння таких культур, як цукровий буряк, рис та мускатний горіх.
Боротьба з бур’янами цукрових буряків набагато складніша та дорожча, порівняно з іншими культурами, через їх меншу конкурентоспроможність. Іноді конкуренція з бур’янами може викликати втрати всього врожаю (100% врожайності). Через пізнє змикання рядків та низьку висоту рослин, бур’яни необхідно майже повністю знищувати, принаймні, до стадії восьмого листочка, щоб уникнути значних втрат. Бурякові поля зазвичай оброблялися сумішами гербіцидів декілька разів протягом вегетаційного періоду. Але багато гербіцидів викликають негативну фітотоксичну дію на буряки. Найбільш критичний період боротьби з бур’янами — 8 тижнів після появи сходів, а терміни обробки посівів досить важко визначити, що може дати неоптимальні результати. Тому наявність сортів, стійких до дії гербіцидів, може покращити боротьбу з бур’янами шляхом зменшення кількості обробок посівів. У 2008 році в США було виведено трансгенний буряк H7-1 як сорт, стійкий до дії гербіцидів. Приблизно 95% посівної площі цукрових буряків у США було засіяно цим сортом. H7-1 був розроблений за допомогою трансформації з використанням агробактерій. Цукровий буряк є дуже складним видом для агробактерій. У результаті чого декілька досліджень показали ефективність трансформації та виведення генетично модифікованих цукрових буряків. Отже, метою даного дослідження є виробництво синтетичного насіння з цукрових буряків із використанням кінчиків пагонів у якості експлантатів, визначення коефіцієнту проростання в лабораторних умовах та придатності штучного насіння до зберігання, а також виведення стійких до дії гербіцидів рослин за допомогою системи трансформації з використанням агробактерій.
Життєздатність синтетичного насіння під впливом зберігання
Синтетичне насіння — це закапсульовані ембріони, пагони, бруньки, клітинні з’єднання або будь-яка інша тканина, яка може бути використана як насіння, що має здатність перетворюватися в рослину в лабораторних умовах або в умовах ex-vitro та може використовуватися після зберігання. Ідіоплазма може ефективно зберігатися у вигляді синтетичного насіння, що пропонує ряд переваг: простоту в роботі, придатність до зберігання, зменшений розмір паростків і транспортну здатність.
Дане дослідження ілюструє впровадження технології синтетичного насіння для масового використання та короткострокове зберігання цукрових буряків (сорти El-Magary та Farida). Для виробництва синтетичного насіння використовувалися експлантати кінчиків пагонів, закапсульовані в розчинах SA1 та SA2 та зберігалися протягом 1, 2, 4 та 8 тижнів при 4°C. Для визначення життєздатності синтетичного насіння після зберігання це насіння пророщувалося в середовищі SIM1 (індукція пагону) (Таблиця 1).
Результати показали, що продовження терміну зберігання більше ніж на тиждень значно знизило відсоток схожості синтетичного насіння. Відсоток схожості штучного насіння сорту El-Magary, закапсульованого в розчині SA1, зменшився зі 100 до 60, 20 та 20%, коли періоди зберігання становили відповідно 1, 2, 4 та 8 тижнів. Однак він зменшився з 80 до 60, 60 та 40%, коли періоди зберігання становили 1, 2, 4 та 8 тижнів відповідно для насіння, закапсульованого в розчині SA2. З іншого боку, відсоток схожості синтетичного насіння сорту Farida, закапсульованого в розчині SA1, зменшився від 100 до 60, 60 і 0%, коли періоди зберігання становили відповідно 1, 2, 4 і 8 тижнів. Однак він зменшився зі 100 до 80, 40 та 20%, коли періоди зберігання насіння склали 1, 2, 4 та 8 тижнів відповідно для насіння, закапсульованого в розчині SA2. Таким чином, розчин SA2 виявився кращим, ніж SA1, оскільки він зберіг життєздатність насіння сорту El-Magary на рівні 40%, а сорту Farida на рівні 20% через 2 місяці зберігання (Таблиця 1, Графік 1).
У дослідженні захисний розчин містив манітол та сорбіт для підвищення життєздатності синтетичного насіння після тривалого періоду зберігання, оскільки вони працюють як осмотичні агенти, що підвищують виживання паростків. Тобто виживання рослин збільшилося за рахунок додавання манітолу та/або сорбіту до розчину. З іншого боку, повідомлялося, що відсоток схожості синтетичного насіння сорту Farida зменшився до 20% за 8 тижнів зберігання, коли використовувався один тільки розчин без манітолу та сорбіту.
Низька температура є найефективнішим способом сповільнення росту клітин. Повідомлялося, що 4°C є найбільш підходящою температурою для зберігання багатьох різновидів протягом тривалого часу. Різниця між сортами Farida та El-Magary полягає в життєздатності насіння після зберігання, що свідчить про вплив генотипу.
Таблиця 1. Відсоток схожості синтетичного насіння під впливом розчину для капсулювання та тривалості зберігання сортів цукрових буряків El-Magary and Farida
| Розчин для капсулювання | Тривалість зберігання | % схожості | |
| El-Magary | Farida | ||
| SA1 | 1 тиждень | 100% | 100% |
| 2 тижні | 60% | 50% | |
| 4 тижні | 20% | 60% | |
| 8 тижнів | 20% | 0% | |
| SA2 | 1 тиждень | 80% | 100% |
| 2 тижні | 60% | 80% | |
| 4 тижні | 60% | 40% | |
| 8 тижнів | 40% | 20% | |
(SA1): розчин для капсулювання, 3% сахарози, 4% альгінату натрію, 2% сорбіту та 2% маніту. (SA2): розчин для капсулювання, 3% сахарози, 1,3 бензиламінопуріну (BAP) + 4% альгінату натрію, 2 % сорбіту та 2% маніту.
Графік 1. Закапсульовані кінчики пагонів та відновлення синтетичного насіння. (a, b) кінчик пагону з альгінатом/агаром; (с, d), пророщений із синтетичного насіння через 2 тижні в розчині для капсулювання
Крива виживання
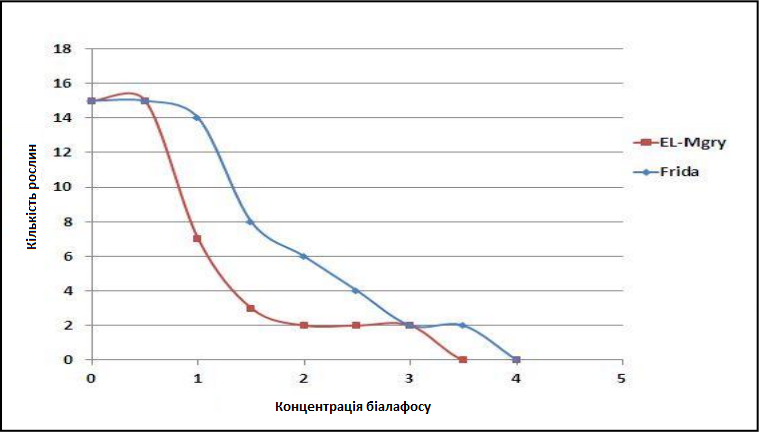
Біалафос — природний гербіцид суцільної дії, що виробляється бактерією Streptomyces hygroscopicus та складається з двох залишків аланіну та глюфосинату. Біалафос використовується для виділення генів у рослинах, трансформованих геном bar, що надає стійкість до білафосу. Сорти Farida та El-Magary вирощувалися у середовищі SIM1 (індукція пагону), що містить (0, 0,5, 1, 1,5, 2, 2,5, 3, 3,5 та 4 мг/л білафосу). Результати показали, що клітини не збільшилися в середовищі з 3,5 мкг/мл біалафосу для Farida і 4 мкг/мл для El-Magary (Графік 2).
Графік 2. Кількість вцілілих експлантатів сортів El-Magary та Farida з різними концентраціями біалафосу
Трансформація цукрових буряків під впливом агробактерій
Трансформація під впливом агробактерій використовується для збільшення стійкості цукрових буряків до неселективних гербіцидів широкого спектру дії (тобто діючої речовини Раундап®, гліфосату, діючої речовини Basta®, глюфосинату та Herbiace®) або до селективних гербіцидів (хлорсульфурону, імідазолінону та сульфонілсечовини). Для дослідження цієї трансформації використовувалися кінчики розвинених пагонів у якості експлантатів.
Для вибору найкращої тривалості спільного вирощування десять експлантатів кожного сорту вирощувалися спільно з Agrobacterium tumefaciens штаму LB4404, утримуючи pISV2678 різний час (5, 10, 15 та 20 хвилин) у середовищі SIM1. Вцілілі експлантати було виявлено через три дні (Таблиця 2).
Таблиця 2. Вплив тривалості спільного вирощування експлантатів обох сортів буряків
| Сорт | Тривалість спільного вирощування (хв) | Відсоток вцілілих експлантатів |
| El-Magary | 5 | 100% |
| 10 | 100% | |
| 15 | 90% | |
| 20 | 70% | |
| Farida | 5 | 100% |
| 10 | 100% | |
| 15 | 90% | |
| 20 | 60% |
Найкращим часом для спільного вирощування було визнано п’ять-десять хвилин завдяки найбільшому відсотку вцілілих експлантатів (100%). Потім експлантати потрапляли в середовище SIM2 (0,5 мг/л 6-бензиладеніну (BA), 0,1 мг/л Індол-3-масляної кислоти (IBA), 500 мг/л цефотаксиму та 3,5, 4 мг/л біалафосу для Farida та El-Magary відповідно. Із 40 експлантатів, підданих впливу агробактерій, було отримано 6 та 9 рослин, що є відсотком ефективності трансформації 15 та 22,5 для Farida та El-Magary відповідно. Отримані рослини вижили та розвинули функціональну кореневу систему в середовищі з 1 мг/л IBA, 500 мг/л цефотаксиму та 3,5, 4 мг/л біалафосу, як селективний субстрат для вирощування рослин. Через 4-6 тижнів вкорінені рослини успішно акліматизувалися в ґрунті в тепличних умовах (Графік 3).
Графік 3. Процес розвитку рослин трансформованого цукрового буряка: (а) пересаджені кінчики пагонів; (b) пересаджені кінчики пагонів через два тижні; (c) формування кореня; (d) підготовка рослин до акліматизації; (е) адаптація рослин у тепличних умовах; (f) заключний етап
Гістохімічний аналіз за допомогою GUS-тесту
Для дослідження активності GUS тканини отриманих рослин цукрових буряків витримувалися в буферному розчині GUS протягом 48 год. (Графік 4). Усі досліджувані тканини стали синього кольору, що вказує на експресію GUS-гену.
Графік 4. Тест-GUS експлантатів кінчиків пагонів з Agrobacterium tumefaciens LBA4404, що містить плазміду (pISV)
Аналіз трансформованої рослини
По 13 рослин із кожного сорту були піддані тесту-ПЛР (полімеразної ланцюгової реакції) для підтвердження наявності трансгена. Результати ПЛР-реакцій, проведені з використанням праймерів, характерних для гена Bar, виявили, що відсоток трансформованих експлантатів становив 18% та 12% для сортів El-Magary та Farida відповідно. Ампліфіковані фрагменти мали очікували розмір 540 bp (Графік 5).
Графік 5. ПЛР-аналіз трансгенних рослин цукрових буряків для гена Bar за допомогою специфічного праймеру. Перша смужка являє собою маркер довжини ДНК 100 bp, смуга C стосується контрольної рослини, смуга від 1 до 13 представляє сорт Farida, а 14-26 — сорт El-Magary.
Аналіз забарвлення листя та його відношення до стійкості до гербіцидів
Баста — універсальний гербіцид суцільної дії, зареєстрований для боротьби з понад 80 видами бур’янів у виробництві широкого діапазону культур. Баста має частково системний принцип дії, що забезпечує вищий рівень безпеки врожаю, порівняно з системними альтернативами, такими як гліфосат.
Через десять днів після зміни забарвлення листя цукрових буряків свіжоприготованим розчином біалафосу (0,2% об./об.), було виявлено хлороз або некроз листя нетрансгенних (контрольних) рослин під фільтрувальним папером, а трансгенні рослини виявилися стійкими до дії гербіциду (Графік 6).
Графік 6. Нетрансгенні та трансгенні рослини цукрового буряка під впливом дослідження забарвлення листя. Лівий горщик представляє контрольну рослину, а правий горщик — стійку до дії гербіцидів рослину.
Вплив гербіциду Баста на трансгенні рослини цукрових буряків
Дані, представлені в Таблиці 3, показали, що обприскування стійких до дії гербіцидів рослин Бастою не вплинуло на ознаки росту з точки зору довжини, діаметру та маси кореня, маси пагону та листової поверхні обох сортів буряків. Крім того, загальний вміст хлорофілу суттєво не змінився під час розпилення Басти. Характеристики якості, такі як відсоток розчинних твердих речовин, відсотковий вміст сахарози та чистоти, значно зменшилися через обприскування рослин гербіцидом Баста на прикладі обох сортів.
Таблиця 3. Деякі агрономічні ознаки двох сортів цукрових буряків, на які впливає гербіцид Баста, не оброблених (контрольних) та оброблених стійких до дії гербіциду рослин
| Агрономічні ознаки | El-Magary | Farida | ||
| Контроль | Трансгенні | Контроль | Трансгенні | |
| Маса кореня (г) | 486а+ | 460а | 372a | 326a |
| Маса пагону (г) | 303а | 313а | 225a | 221a |
| Листова поверхня рослини (см2) | 325,12а | 337,05а | 314,60a | 286,50a |
| Загальний вміст хлорофілу (SPAD-502) | 41,30а | 37,50а | 35a | 30,20a |
| Довжина кореня (см) | 34а | 28а | 26а | 22а |
| Діаметр кореня (см) | 18а | 16а | 15а | 12а |
| Загальний вміст розчинних твердих речовин, % | 18,90а | 17,35b | 18,30a | 16,55b |
| Сахароза, % | 16,60а | 14,30b | 15a | 13,80b |
| Чистота, % | 87,83а | 82,42b | 81,97a | 83,38b |
+ різні літери позначають значну різницю між обробленими та необробленими рослинами.
Аналіз довільно ампліфікованої поліморфної ДНК (RAPD)
Аналіз довільно ампліфікованої поліморфної ДНК проводився для перевірки генетичної стійкості трансформованих паростків рослин після акліматизації. Всього 13 праймерів RAPD використовувалися для скринінгу та збору зразків ДНК контрольних рослин, стійких до дії гербіцидів рослин та рослин, вирощених із синтетичного насіння, обох сортів буряків. Розмір ампліфікованих фрагментів становив від 50 до 2000 bp, а стійкі до дії гербіцидів рослини та синтетичне насіння були генетично подібними на контрольну рослину (Графік 7).
Вважається, що кінчики пагонів є стабільно генетичними, в свою чергу, висока ймовірність генетичних змін у культурі каллюсу та протопласту. Отримані результати також показали, що зберігання не викликає генетичних змін.
Графік 7. Аналіз RPAD-PCR 13 праймерів контрольних рослин (С), стійких до дії гербіцидів рослин (Т) та рослин, вирощених із синтетичного насіння (S), обох сортів Farida (F) та El-Magary (Е); (М) маркер довжини ДНК 1 кб
|
Висновки Дане дослідження було проведено з метою вивчення синтетичного (штучного) насіння та генотипів цукрових буряків, стійких до дії гербіцидів, із використанням кінчиків пагонів, закапсульованих у комплексному розчині 4% альгінату натрію зі 100 ммоль Са (NO3) 24Н2О. Досліджувалися два розчини на предмет ефективності капсулювання — розчин SA1 (3% сахарози, 4% альгінату натрію, 2% сорбіту та 2% маніту) та розчин SA2 (3% сахарози, 1,3 бензиламінопуріну (BAP) + 4% альгінату натрію, 2% сорбіту та 2% маніту). Синтетичне насіння зберігалося в темряві при 4°С для уповільнення росту всіх тканин протягом різного періоду, від 1 до 8 тижнів. Після чого визначалася його життєздатність шляхом проростання у двох різних середовищах (SA1 та SA2). Отримані результати показали, що розчин SA2 виявив більшу ефективність закапсульованоно відростання. Для трансформації кінчиків пагонів сортів буряків El-Magary та Farida використовувалися агробактерії, що переносять рослинний вектор PISV 2678. Було використано метод відбору стійких до біалафосу рослинних паростків, культурних експлантатів у середовищі, що містить біалафос (3,5 та 4 мг/л), для El-Magary та Farida відповідно. Інший метод використовувався для відбору стійких до біалафосу рослинних паростків із геном bar за допомогою полімеразної ланцюгової реакції (ПЛР) та дослідження забарвлення листя. Результати показали, що сорт El-Magary має більшу ефективність трансформації (18%), ніж Farida (12%). Генетична стабільність закапсульованих рослин була реалізована за допомогою ПЛР із випадковою ампліфікацією поліморфної ДНК, не було виявлено значної мінливості між закапсульованими та контрольними рослинами. Дане дослідження дозволило оцінити стійкість цукрових буряків до дії гербіцидів та виробництво генетично стійкого синтетичного насіння з кінчиків пагонів буряків. Застосування цієї методики може бути корисним для виробництва синтетичного насіння як економічно ефективний спосіб заощадження часу. Успішне вирощування рослин із синтетичного насіння після 2-місячного зберігання при температурі 4°C вказує на те, що описаний у цьому дослідженні метод може бути використаний для тривалого зберігання ідіоплазми цукрових буряків. |